Flow cytometry in the molecular mechanism of Treg immune regulation

(一) 富集Treg
流式细胞技术可以富集Treg细胞,但常用磁珠富集法,不使用流式富集。因为Treg细胞在T细胞中的比例只有10%左右,如果直接进行流式的富集分选,将会增加上机时长,从2小时延长到4-5小时,对细胞状态有不良影响。
(二) 分选
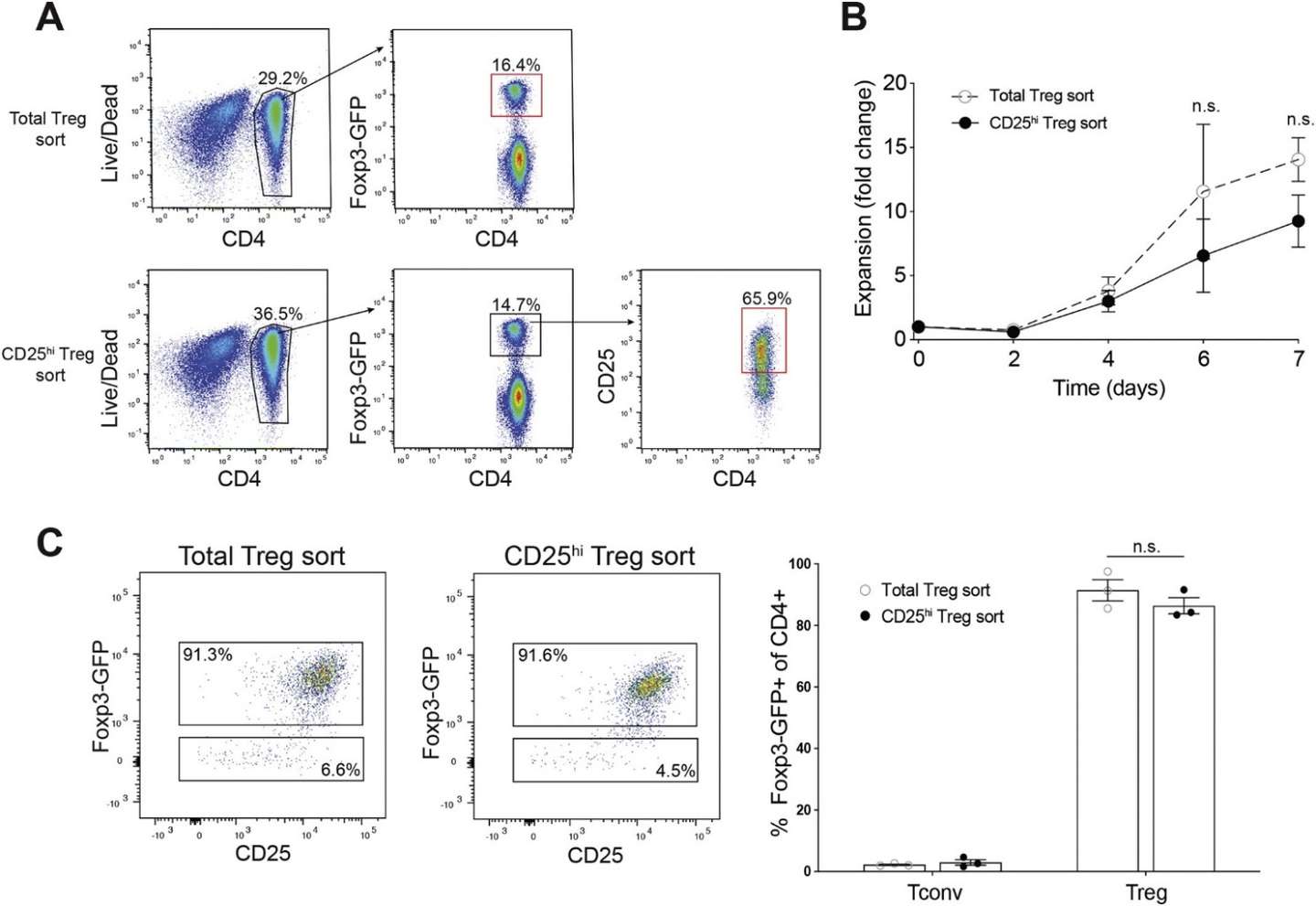
流式细胞技术可以得到高纯度的Treg。使用抗CD4-FITC抗体、抗CD25-PE抗体和抗CD127-APC抗体进行表面染色,通过检测细胞表面标志CD4、CD25和CD127分选高纯度的Treg(图1)
Fig1.Foxp3GFP小鼠脾脏和淋巴结Treg分选。Tregs分为CD4+Foxp3-GFP+总Tregs(上图红门)和CD4+Foxp3-EGFP+CD25hi Tregs(下图红门)。[1]
(三)多色分型
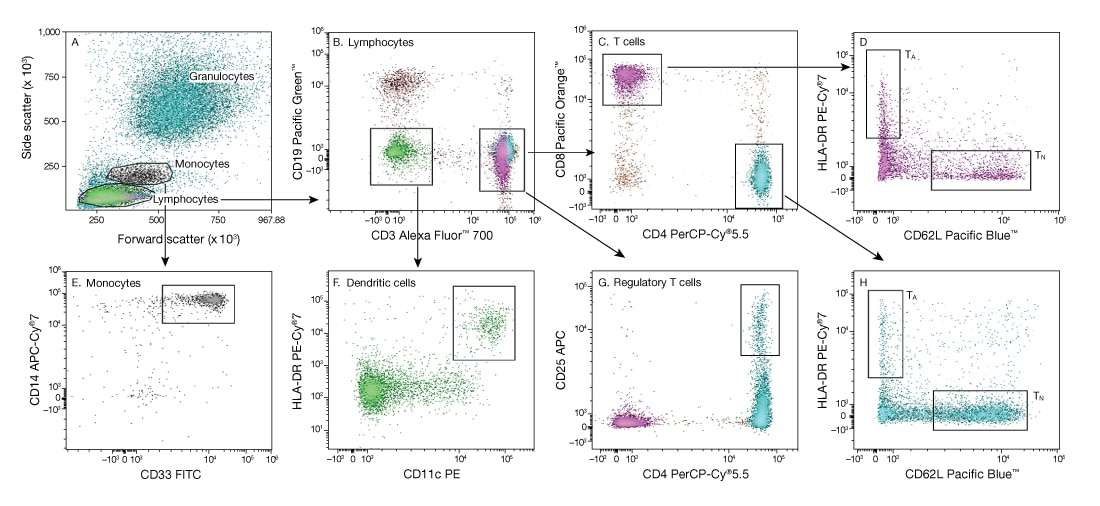
多色流式细胞术的优势在于能够使用多个标记物进行Treg细胞研究,能够使用多个分析物使细胞数据相关联,获得准确界定的细胞群(图2)。此外,多色实验可通过减少样品和样品体积需求量并提高样品通量,进而提高效率。[1]
Fig2.多色流式细胞仪对人外周血单核细胞(PBMC)进行10色免疫分型。 根据前向散射和侧向散射图为淋巴细胞和单细胞设门 (A)。 在淋巴细胞门内,可根据CD3的表达分离T细胞 (B),并进一步将其细分为CD4+和CD8+亚群 (C)。 此外,调节性T细胞可表达CD4和CD25 (G),是主要外周耐受的重要媒介。 根据CD62L的表达可区分初始CD4+和CD8+ T细胞(TN),而HLA-DR由活化T细胞(TA) (D,H)表达。 DC细胞存在于外周血中,通常对T和B细胞谱系标记呈阴性,并且共同表达整合素CD11c和HLA-DR (F)。 在散射图中,单核细胞恰好位于淋巴细胞上方 (A),并且表达CD14和CD33 (E)。
(四)细胞扩增
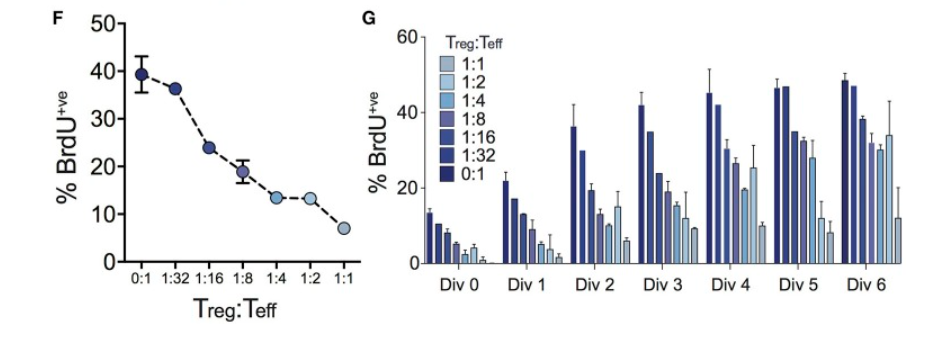
BrdU、Annexin V-FITC/PI等方法可检测Treg和Teff的增殖和凋亡(图3和图4)。
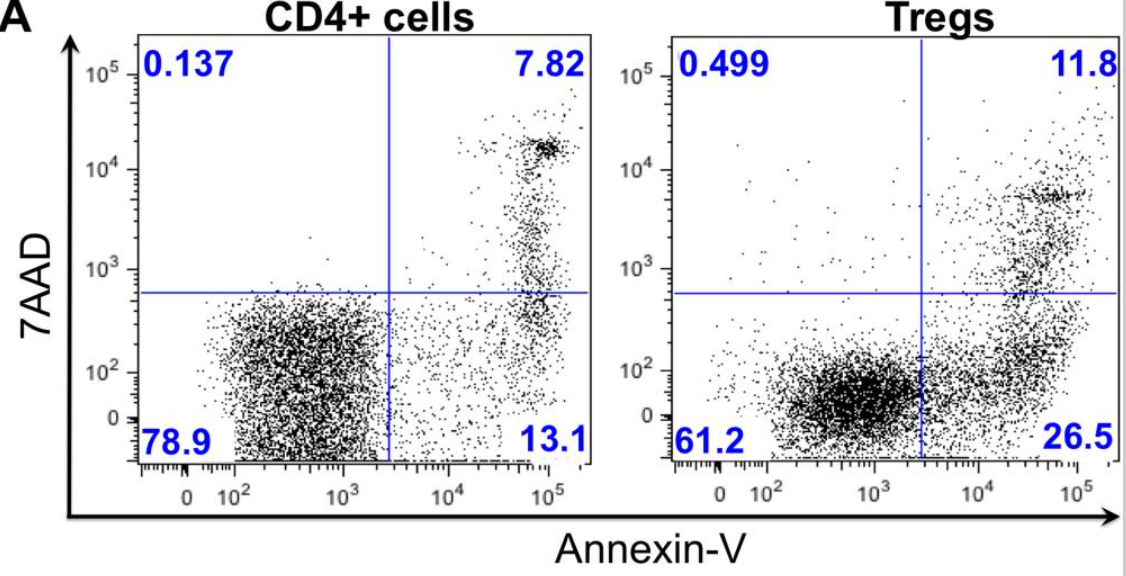
Fig3.分析Treg对Teff细胞分裂的影响。通过检测BrdU的掺入来判断细胞增殖能力。[2]
Fig4. CD4+细胞和Treg细胞进行Annexin V和7AAD染色,分析解冻后的细胞存活率和凋亡情况。[3]
(五)检测Treg/Th17的可塑性和稳定性
近年研究表明,Foxp3+Treg具有一定的不稳定性和可塑性。“不稳定性””指Treg细胞的表型和功能发生变化,“可塑性”指Treg细胞的功能发生转化,由免疫抑制功能转化为具有其他功能的细胞。在一定条件下,少部分小鼠Treg细胞丢失Foxp3的表达,转化为Th17或效应T细胞,促进Th17细胞免疫反应。[4]
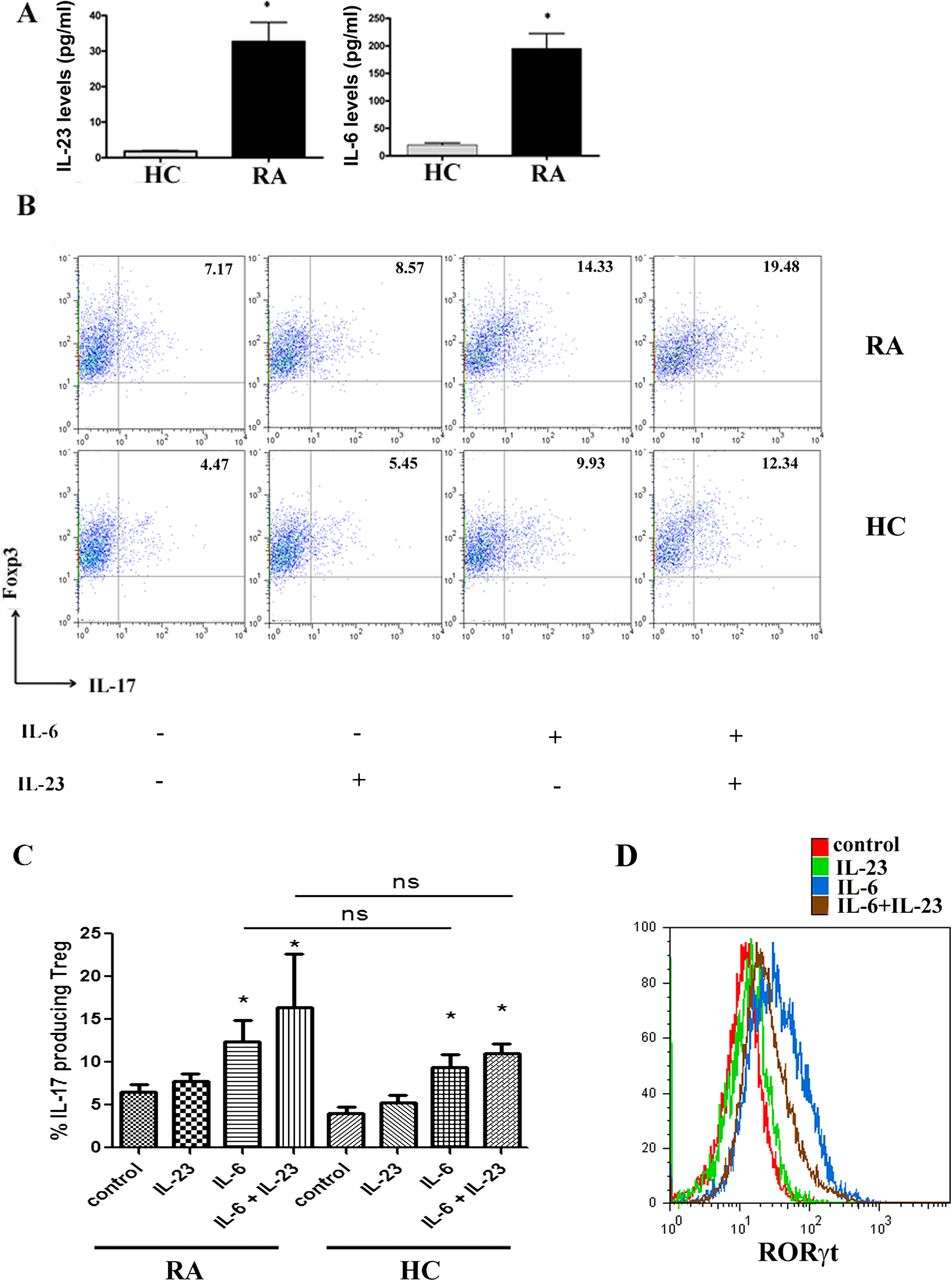
因为流式细胞技术能够很好地展示表观遗传学的变化情况,适用于Treg的稳定性和可塑性机制研究。(图5)
Fig5. RA炎症条件诱导外周血调节性T细胞转化为产生IL-17的CD4 Treg细胞[5]
(六)流式胞内检测
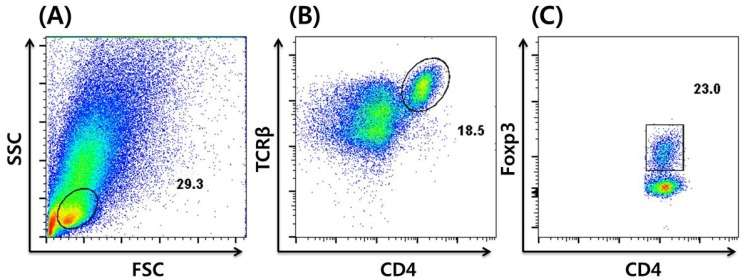
流式胞内以及核蛋白染色用于检测细胞因子的表达、分泌蛋白水平和蛋白的磷酸化。在染胞内或胞核内的因子时,要对细胞进行固定和破膜。对于分泌蛋白来说,首先用蛋白分泌阻断剂处理细胞,使目标蛋白在细胞内积累。因此,与活细胞相比,T细胞在形态上会有一定变化,在FSC/SSC图中对固定和破膜的样品细胞圈门时需要做一定调整。以Foxp3胞内染色为例, 在固定、破膜和抗Foxp3-AF647抗体染色后,设门方式相比于图1有一些调整(图6)。
Fig6.流式细胞仪分析胞内染色Foxp3的Tregs。分别对淋巴细胞、T细胞和Foxp3+Treg细胞设门,数字表示门内的细胞占图中细胞总数的百分比。[6]
(七)功能检测

基于运用荧光染料 (如CellTrace Violet、CFSE等) 标记T细胞,并在每个细胞分裂时在子细胞之间平均分配这一原理,通过流式细胞术来追踪Treg细胞的活化增殖及其体外免疫抑制活性(图7)。
Fig7.用羧基荧光素琥珀酰亚胺酯(CFSE)稀释法测定Treg的抑制作用。从C57BL/6小鼠体内分离出Tconv,用CFSE标记。抗CD3 、抗CD28激活细胞,以4:1的Tconv:Treg比例共培养。72h后,流式细胞仪检测细胞增殖。[7]
References
[1] Wu D, Wong M Q, Vent-Schmidt J, et al. A method for expansion and retroviral transduction of mouse regulatory T cells[J]. Journal of Immunological Methods, 2021, 488: 112931.
[2] Dowling M R, Kan A, Heinzel S, et al. Regulatory T Cells Suppress Effector T Cell Proliferation by Limiting Division Destiny[J]. Frontiers in immunology, 2018, 9: 2461-2461.
[3] Gołąb K, Grose R, Placencia V, et al. Cell banking for regulatory T cell-based therapy: strategies to overcome the impact of cryopreservation on the Treg viability and phenotype[J]. Oncotarget, 2018, 9(11): 9728-9740.
[4] 韩俊燕, 曾辉. 调节性T细胞的稳定性和可塑性[J]. 免疫学杂志, 2015, 31(09): 816-819.
[5] Wang T, Sun X, Zhao J, et al. Regulatory T cells in rheumatoid arthritis showed increased plasticity toward Th17 but retained suppressive function in peripheral blood[J]. Annals of the Rheumatic Diseases, 2015, 74(6): 1293-1301.
[6] Kim W, Lee H. Advances in nutritional research on regulatory T-cells[J]. Nutrients, 2013, 5(11): 4305-4315.
[7] Collison L W, Vignali D a A. In vitro Treg suppression assays[J]. Methods in molecular biology (Clifton, N.J.), 2011, 707: 21-37.