Flow cytometry

思考题:根据自己专业方向或研究课题内容设计细胞分选实验方案,如多色标记样品中3-4种细胞分选,包括试剂订购、实验对照管设计、样品制备过程、分选上机前的准备、画出流式分析图、并圈门指出哪些是要分选的细胞群,需要做几路分选收取目的细胞?如何做纯度分析?
仪器选择
BD FACS Aria SORP(Special Order Research Product) 6激光18参数
试剂订购
| 抗体名称 | Source | 克隆号 | 稀释度 |
|---|---|---|---|
| Anti-mouse CD4-APC | BD | 1:400 | |
| Anti-mouse CD25-PE-Cy7 | BD | 1:400 | |
| Anti-mouse CD44-Pacific blue | BD | 1:400 | |
| Anti-mouse CD62L-APC-Cy7 | BD | 1:400 | |
| anti-CD62L-FITC | BioLegend | 104406 | Use at 1:100 |
| anti-CD25-PE | BioLegend | 102008 | Use at 1:400 |
| anti-CD4-PerCP | BioLegend | 100434 | Use at 1:1000 |
| anti-CD44-APC | BioLegend | 103012 | Use at 1:500 |
对照管设计
| 阳性对照 | 空白对照 | 同型对照 | 单阳对照 | FMO | 试验样品 |
|---|---|---|---|---|---|
| 阳性样本,可以没有,1管 | blank,不染色,1管 | PE-IgG,APC-IgG,Percp-IgG,FITC-IgG混合一个管中。 | 分别只染一个颜色,4管 | 荧光减一,可以不做,4管 | 染所有荧光素 |
样品制备


获取细胞悬液(磁珠富集)→荧光抗体染色→调整细胞浓度(1~10 X 106 cells/ml)→过滤细胞→移入流式管→避光置冰上运至分选室→上机检测并设定分选条件→分选细胞→上机回测,检测纯度。
分选上机前准备
1、单细胞悬液样品(推荐使用0.1-1.0%BSA-PBS溶液重悬样品),上机前使用300目滤网过滤(推荐BD滤网),禁止使用含血清的培养基或PBS溶液。上机前务必去除样品中之细胞团块,过滤以免管路堵塞。
2、无菌制备,避免样品带菌对设备造成污染,进而影响其他用户的无菌分选实验。
3、根据您的样本种类和选择的荧光标记物,与仪器管理人员沟通确认所使用荧光滤光片和喷嘴直径。
若欲分选GFP、RFP等单色基因转染的样品,需提供未经转染的相同细胞为对照组标本,以作为分选前机器校正用。若以多种荧光染色进行分选,需提供各种单一荧光染色的标本作为分选前仪器校正用。
4、另需要准备:收集管或收集板(可以加入少量培养基或buffer),上样缓冲液或者PBS(可能需要稀释样品)。
浙大生科版本:
a) 保证样本的无菌状态,因为分选得到的细胞还要继续培养;
b) 不能使用固定剂固定细胞,因为活细胞经固定剂处理后即死亡;
c) 保证上机样品为单细胞悬液;
d) 准备充足的细胞;
e) 建议分选上样管中的缓冲液使用含2% FBS的PBS,普通培养基中的酚红可能会干扰分选;若用培养基的话,颜色不能太深,血清浓度不能超过2%,否则粘性太大影响分选。
f) 如细胞分选后需再次培养,请准备含血清的收集管,在分选前交操作员。建议在5ml离心管中加入1-2ml血清及其它必需组分,保证分选完毕时血清浓度大于5%,(建议使用含20%FBS的DMEM);
g) 如要分选GFP等转染的样品,请提供未经转染的相同细胞为阴性对照;
h) 如要做多重荧光染色标本的分选,请提供各种单一荧光染色的标本(如有光谱重叠,需要做荧光补偿调节);
i) 如要去除死细胞,在不影响后续实验前提下,可以加入7-AAD或是PI;
j) 快速简便的样本处理有利于分选:处理好的样本尽快上机,分选好的细胞尽快下一步实验,如果要分选多个样本,建议一次处理一个,估计可能的上机时间后,再处理第二个样本
画图圈门
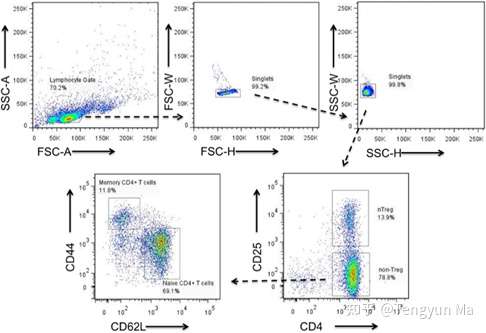
1路分选收取目的细胞,纯度分析
Purity=分选得到的目的细胞/分选得到的总细胞,取少量分选出的目的细胞再次上机分析,分析目的细胞占全部细胞的百分比