Autophagy



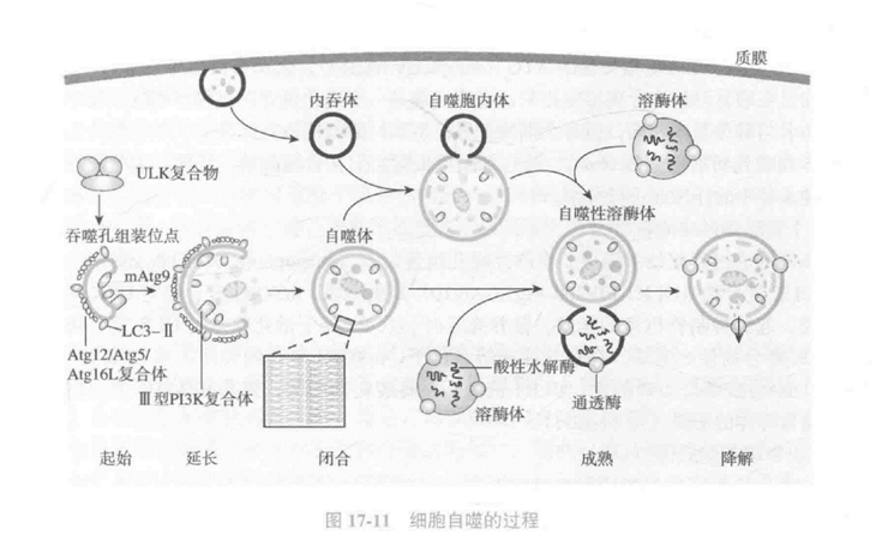
过程及蛋白复合物:
- 自噬体的形成与启动
自噬体形成过程起始于细胞质中的吞噬孔组装位点(吞噬前体,PAS)PAS主要由ULK复合物(类泛素化修饰的蛋白共价修饰系统)聚集组成。mTOR1复合物对ULK复合物进行负调控。
- 自噬囊泡成核
起始吞噬膜的成核与组装是由P13K复合物(Vps34-p150-mAtg14-Beclin1)来调节的。
- 囊泡延伸
Atg12和LC3两个连接系统参与自噬囊泡的延伸与扩展。
- 自噬性溶酶体
自噬体育溶酶体的融合需要溶酶体膜蛋白LAMP-2和小GTPase Rab7的参与。
如何鉴定一个新的自噬相关基因?简述检测方法以及原理。
一定要电镜、LC3和P62
一:形态学方法
电子显微镜:电镜作为自噬检测的金指标。由于自噬体属于亚细胞结构,普通光镜下观察不到自噬体的形成,因此,直接观察自噬体需在透射电镜下。自噬囊泡的特征为:新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。自噬体(AV1)的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。自噬溶酶体(AV2)的特征为:单层膜,胞浆成分已降解。
二:自噬体标记蛋白的检测
LC3 (微观相关蛋白1轻链3)是细胞自噬泡膜的通用标记物,LC3‐I分布于细胞质,LC3‐II定位于自噬泡和成熟自噬体表面。LC3‐II 的含量在某种程度上反应细胞自噬活性。
1.利用 western blot 检测LC3‐II/I 比值的变化以评价自噬形成:自噬LC3‐II 含量增多,LC3‐II/LC3‐I 比例的升高
2.内源性斑点状 LC3 增多:免疫荧光染色,免疫电镜
3.斑点状 GFP‐LC3 增多,借助荧光显微镜可检测内源性lc3或外源表达的GFP-LC3融合蛋白。
三:自噬流/潮(autophagic flux)的检测
1.p62/SQSTM1和Free GFP检测:p62-GFP,在自噬发生时被自噬-溶酶体降解,同时游离出GFP,利用western blot检测自噬发生时游离的p62,自噬发生时p62表达量下调(反比),而free GFP上调。
2.PloyQ80降解检测细胞自噬流:(荧光标记)PloyQ80-luc是自噬降解途径,PloyQ19-luc是蛋白酶降解途径,自噬时仅前者后影响,根据PloyQ80-luc/PloyQ19-luc比值检测自噬流。
3.mRFP-GFP-LC3 双荧光自噬指示体系:由于GFP荧光蛋白对酸性敏感,当自噬体与溶酶体融合后GFP荧光发生淬灭,mRFP红色荧光蛋白能很好耐受酸性环境。所以通过构建mRFP-GFP-LC3 双标记蛋白,可以巧妙监控自噬体向溶酶体转化的步骤。在诱导细胞自噬后,可观察到自噬体(RFP+GFP)呈黄色标记,自噬性溶酶体(mRFP)呈红色标记,通过不同颜色斑点计数可看出自噬流强弱,实时监测自噬的发生。
4.RFP-anti+lamp1与GFP-anti+lc3共定位:LAMP1是溶酶体膜蛋白1,利用溶酶体自噬体融合后荧光共定位来进行检测。
5.溶酶体功能检测:
LysoTracker染色,Cathepsin B及CathepsinD等的分析等
(六)其它: ZFYVE1/DFCP1, ATG9, ATG12-ATG5, ATG16L, BECN1, mTOR, AMPK和Atg1/ULK1激酶活性
(七)自噬抑制剂的应用
3-甲基腺嘌呤(3-Methyladenine, 3-MA): 作用于PI3K通路
渥曼青霉素(Wortmannin): 作用于PI3K通路
ATG siRNA:利用RNAi 原理沉默ATG基因表达,抑制自噬
:自噬与免疫系统相互利用、相互协同以及相互拮抗,发挥免疫防御、免疫自稳以及免疫监视功能。
1.在固有免疫应答中,自噬参与病原体的清除。细胞内的病原体被自噬体包裹,迅速转移至溶酶体降解。然而(病原体在长期建化过程中产生对抗细胞自噬的独特机制,)一些病毒蛋白也能够通过抑制自噬来维持自身的生存。如HSV-1、卡波济肉瘤相关疱疹病毒(KSHV)等编码的蛋白能够与BECN1 结合,抑制BECN1/PIK3C3复合物的形成,阻止自噬的发生; 禽流感病毒的M2 蛋白可以阻断自噬体和溶酶体的融合过程, 阻止自噬体的降解, 利于病毒的存活
2.在适应性免疫应答中,自噬参与抗原提呈过程,与免疫细胞生长及分化高度相关,进而影响相应的免疫应答过程。同时,自噬在系统性红斑狼疮、类风湿性关节炎、特发性炎性肌病以及其自身免疫相关疾病如炎性肠病、多发性硬化等发生发展中起一定作用。
3.细胞因子对自噬的双重调节作用:
感染早期与IFN-I协同抵抗病毒感染;感染晚期又可作为负调控机制抑制IFN-I的持续产生,以维持适度的炎症反应。